F A C H H O C H S C H U L E W E D E L
Seminararbeit Thermodynamik, Energie und Umwelt
in der Fachrichtung
Physikalische Technik
Thema:
Thermodynamik irreversibler Prozesse
| Eingereicht von: |
Udo Becker |
| Erarbeitet im: | 6. Semester |
| Abgegeben am: | 3. Januar 1996 |
| Referenten: |
Prof. Dr. Michael Anders und |
Die Gleichgewichts-Thermodynamik gibt nur Antwort auf die Fragen nach der Lage eines Gleichgewichtes und ob ein Vorgang thermodynamisch möglich ist oder nicht. Darüber hinaus gehende Fragen lassen sich mit ihrer Hilfe nicht beantworten. Die Zeit spielt in der Gleichgewichts-Thermodynamik keine Rolle. Man erhält keine Antwort auf die Frage, welcher Vorgang schnell oder langsam abläuft.
Hier setzt die Thermodynamik irreversibler Prozesse an. Es werden Vorgänge in Systemen betrachtet, die sich nicht im thermodynamischen Gleichgewicht befinden. Beispiele für irreversible Prozesse sind der Temperaturausgleich, der Konzentrationsausgleich durch Diffusion, die innere Reibung oder die chemische Stoffwandlung.
Die Thermodynamik irreversibler Prozesse beschäftigt sich mit der Anwendung thermodynamischer Methoden auf dynamische (zeitabhängige) Vorgänge. Sie entstand 1931 mit Onsagers thermodynamischer Deutung der Reziprokenrelation und ihrer statistischen Herleitung. Ihre Blütezeit begann 1945 in Brüssel mit den Arbeiten von Prigogine über nicht-lineare Thermodynamik, in denen Themen wie Stabilitäts-kriterien, oszillierende Reaktionen, dissipative Strukturen und die biologische Evolution im Vordergrund standen. Onsager erhielt den Nobelpreis 1968, Prigogine 1977.
Für die Beschreibung irreversibler Prozesse, z.B. für den Wärmeausgleich zwischen zwei Punkten unterschiedlicher Temperatur, sind räumlich und zeitlich variable Zustandsfunktionen einzuführen. In der Gleichgewichts-Thermodynamik werden die extensiven Zustandsgrößen einem System als ganzes zugeordnet, nicht jedoch einzelnen Punkten. Der Übergang zur Thermodynamik irreversibler Prozesse erfolgt durch Unterteilung des Systems in Teilsysteme. Ein Teilsystem muß einerseits so klein sein, daß seine einzelnen Punkte in ihren Eigenschaften und Zuständen nicht merklich voneinander abweichen. Es muß andererseits noch so groß sein, daß statistische Gesetze gelten, d.h. atomistische Effekte nicht hervortreten.
Die Entropie ist eine Zustandsfunktion. Nach der Clausiusschen Ungleichung gilt für einen beliebigen Vorgang
![]() .
.
Dabei steht das Zeichen > für eine spontan ablaufenden Vorgang und das Zeichen = für einen reversiblen Vorgang.
Bei jeder Zustandsänderung kann die Entropieänderung ![]() eines Systems additiv in einen Anteil
eines Systems additiv in einen Anteil ![]() zerlegt werden, der sich aufgrund des Stoff- und Energieaustausches mit der
Umgebung ergibt, und einen Anteil
zerlegt werden, der sich aufgrund des Stoff- und Energieaustausches mit der
Umgebung ergibt, und einen Anteil ![]() ,
der auf innere Prozesse, z.B. Temperaturausgleich, zurückzuführen
ist.
,
der auf innere Prozesse, z.B. Temperaturausgleich, zurückzuführen
ist.
![]()
Nach dem zweiten Hauptsatz gilt stets
![]()
mit dem Gleichheitszeichen für Gleichgewichtsprozesse und dem Größerzeichen
für alle realen Prozesse. ![]() kennzeichnet
zu- oder abströmende Entropie. Für ein abgeschlossenes System gilt
kennzeichnet
zu- oder abströmende Entropie. Für ein abgeschlossenes System gilt
![]() = 0 und damit
= 0 und damit
![]() .
.
![]() ist der Teil der Entropieänderung,
der bei dem Prozeß erzeugt wird und demnach ein Maß für die
Irreversibilität eines Prozesses.
ist der Teil der Entropieänderung,
der bei dem Prozeß erzeugt wird und demnach ein Maß für die
Irreversibilität eines Prozesses.
Im Gegensatz zur Gleichgewichts-Thermodynamik spielt die Zeit in der irreversiblen
Thermodynamik eine wichtige Rolle. Es ist möglich, Zustandsfunktionen und
andere Größen nach der Zeit zu differenzieren und Gesetzmäßigkeiten
zwischen den Ableitungen nach der Zeit herzuleiten. Eine zentrale Bedeutung
kommt dabei der Entropieproduktion ![]() zu:
zu:
![]() ,
,
denn jede Analyse eines irreversiblen Prozesses beginnt mit der Aufstellung einer Formel, die die Entropieproduktion bei diesem Prozeß beschreibt. Die Entropie-produktion gibt die auf die Zeiteinheit bezogene Entropiezunahme in einem System durch innere Prozesse an.
Die Zustandsgrößen der Energie und die Entropie sind in einigen
Fällen auf die Masseneinheit (kg) oder auch auf ein Mol bezogen. Bei irreversiblen
Prozessen, bei denen sowohl Stoff als auch Energieaustausch stattfinden kann,
ist es in diesen Fällen zweckmäßig, die Entropieänderung
auf die Volumeneinheit zu beziehen. Hieraus ergibt sich ![]() ,
die Entropie je Volumeneinheit, in J
,
die Entropie je Volumeneinheit, in J ![]() .
Die zeitliche Ableitung hieraus ergibt die Entropieproduktion
.
Die zeitliche Ableitung hieraus ergibt die Entropieproduktion ![]() ,
hier mit der Dimension Energie pro Zeit, Volumen und Temperatur. Diese Größe
wird auch als Quelldichte der Entropie bezeichnet.
,
hier mit der Dimension Energie pro Zeit, Volumen und Temperatur. Diese Größe
wird auch als Quelldichte der Entropie bezeichnet.
Ein irreversibler Prozeß, der besonders leicht zu behandeln ist, ist
der Temperaturausgleich. Es soll ein abgeschlossenes System betrachtet werden,
das aus zwei Wärmereservoiren mit den Temperaturen ![]() und
und ![]() besteht.
besteht.
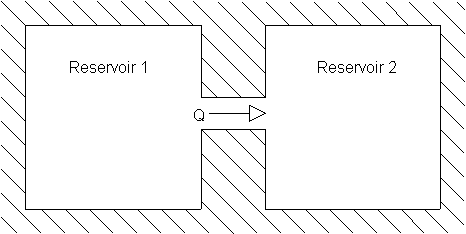
Abbildung 1: Zwei wärmeleitend miteinander verbundene Teilsysteme
Die beiden Reservoire sind so miteinander verbunden, daß zwischen ihnen
Wärmeleitung möglich ist. Es wird ![]() >
>![]() angenommen, und es soll die Wärmemenge Q von dem Reservoir 1 in das Reservoir
2 fließen. Die Wärmereservoire sollen aber so groß sein, daß
sich ihre Temperatur bei diesem Prozeß nicht merklich ändert. Jetzt
läßt sich berechnen, wie sich bei dem Prozeß die Entropie in
den beiden Reservoiren ändert: Weil
angenommen, und es soll die Wärmemenge Q von dem Reservoir 1 in das Reservoir
2 fließen. Die Wärmereservoire sollen aber so groß sein, daß
sich ihre Temperatur bei diesem Prozeß nicht merklich ändert. Jetzt
läßt sich berechnen, wie sich bei dem Prozeß die Entropie in
den beiden Reservoiren ändert: Weil ![]() und
und ![]() konstant sind, resultiert für
das Reservoir 1
konstant sind, resultiert für
das Reservoir 1
![]()
und für das Reservoir 2
![]() .
.
Nach Voraussetzung ist das System insgesamt abgeschlossen, folglich ist ![]() = 0, und die mit der Wärmeleitung verbundene Entropieänderung des
Systems kann mit der Gleichung
= 0, und die mit der Wärmeleitung verbundene Entropieänderung des
Systems kann mit der Gleichung
![]()
beschreiben werden, aus der folgt
![]() .
.
Für differentielle Wärmeübergänge dQ erhält diese Gleichung die Form
![]() .
.
Differentiation nach t liefert die Entropieproduktion im System:
![]() .
.
2.2. Entropiestromdichte / Bilanzgleichung der Entropie
Um die durch Strömungs- und Austauschprozesse bewirkte Entropieänderung
zu erfassen, wird die Entropiestromdichte ![]() eingeführt. Sie gibt die durch die Fläche A fließende Entropie,
bezogen auf die Zeit- und Flächeneinheit an. Kennzeichnet
eingeführt. Sie gibt die durch die Fläche A fließende Entropie,
bezogen auf die Zeit- und Flächeneinheit an. Kennzeichnet ![]() die Entropiezunahme durch Austauschprozesse, bezogen auf die Volumen- und Zeiteinheit,
so besteht für das Volumen V mit der Oberfläche A die Beziehung
die Entropiezunahme durch Austauschprozesse, bezogen auf die Volumen- und Zeiteinheit,
so besteht für das Volumen V mit der Oberfläche A die Beziehung
![]() .
.
Der Vektor ![]() weist aus dem Gebiet
V heraus, d.h. abfließende Entropie bewirkt in V Entropieabnahme oder
negativen Entropiezuwachs. Mit Hilfe des Gausschen Satzes erhält man
weist aus dem Gebiet
V heraus, d.h. abfließende Entropie bewirkt in V Entropieabnahme oder
negativen Entropiezuwachs. Mit Hilfe des Gausschen Satzes erhält man
![]()
und damit aus dem Vergleich der Integranten und aufgrund der Definition der Entropieproduktion
![]() .
.
Für die Entropiezunahme
![]()
bei irreversiblen Prozessen in einem nichtabgeschlossenen System folgt aufgrund der Definitionsgleichung der Entropieproduktion und der Definition der Entropie-stromdichte
![]() .
.
Darin gibt ![]() die Entropiezunahme je
Kubikmeter und je Sekunde an,
die Entropiezunahme je
Kubikmeter und je Sekunde an, ![]() kenn-zeichnet
in gleicher Weise die Entropieproduktion, die allein durch innere Prozesse erfolgt.
kenn-zeichnet
in gleicher Weise die Entropieproduktion, die allein durch innere Prozesse erfolgt.
![]() bedeutet die Entropie je Kubikmeter,
bedeutet die Entropie je Kubikmeter,
![]() die strömende Entropie je Quadratmeter
und je Sekunde.
die strömende Entropie je Quadratmeter
und je Sekunde.
Jeder Prozeß setzt sich aus einzelnen Teilprozessen
zusammen. Die Entropie-produktion s
eines komplexen Prozesses folgt additiv aus Entropieproduktionen ![]() der einzelnen Teilprozesse. Faßt man die Entropieproduktion eines Teilprozesses
als Produkt eines generalisierten thermodynamischen Flusses
der einzelnen Teilprozesse. Faßt man die Entropieproduktion eines Teilprozesses
als Produkt eines generalisierten thermodynamischen Flusses ![]() und einer generalisierten thermodynamischen Kraft
und einer generalisierten thermodynamischen Kraft ![]() auf, so erhält man für die Entropieproduktion des komplexen Prozesses
auf, so erhält man für die Entropieproduktion des komplexen Prozesses
![]()
![]() und
und ![]() können Skalare, Vektoren oder Tensoren sein. Dementsprechend erfolgt die
Verknüpfung der beiden Größen durch die einfache Multiplikation,
die skalare Multiplikation oder durch die doppelte Kontraktion. Die Einheiten
von
können Skalare, Vektoren oder Tensoren sein. Dementsprechend erfolgt die
Verknüpfung der beiden Größen durch die einfache Multiplikation,
die skalare Multiplikation oder durch die doppelte Kontraktion. Die Einheiten
von ![]() und
und ![]() können je nach Teilprozeß unterschiedlich sein, das Produkt
können je nach Teilprozeß unterschiedlich sein, das Produkt ![]() hat in jedem Fall die Dimension Energie pro Zeit und Temperatur. Wenn die Flüsse
und Kräfte zusammengehören, d.h. ihr Produkt die Entropieproduktion
ergibt, so spricht man von korres-pondierenden Flüssen und Kräften.
hat in jedem Fall die Dimension Energie pro Zeit und Temperatur. Wenn die Flüsse
und Kräfte zusammengehören, d.h. ihr Produkt die Entropieproduktion
ergibt, so spricht man von korres-pondierenden Flüssen und Kräften.
Als thermodynamischen Fluß erhält man im allgemeinen die Ableitung einer physikalischen Meßgröße nach der Zeit. Im Beispiel des Temperaturausgleiches wäre das
![]() .
.
Die hierzu korrespondierende thermodynamische Kraft, die den Fluß hervorruft, wäre demnach
![]() .
.
Die Zerlegung der Entropieproduktion in ein Produkt aus Fluß und Kraft ist jedoch nicht immer eindeutig. Ein Hilfsmittel zum erkennen der Flüsse und Kräfte bietet die Überprüfung auf Zeitinversion. Die beiden Faktoren J und X unterscheiden sich voneinander in grundsätzlicher Weise. Läßt man den Vorgang in Gedanken rückwärts ablaufen, so kehrt ein Faktor sein Vorzeichen um. Solche Größen werden als thermodynamische Flüsse bezeichnet. Der andere Faktor, der Koeffizient der thermodynamischen Flusses in der Entropieproduktion, ändert sein Vorzeichen nicht. Solche Größen werden als thermodynamische Kräfte bezeichnet. Thermodynamische Kräfte sind gegenüber Zeitinversion invariant.
2.3.2. Beispiel Elektrischer StromIn der Thermodynamik irreversibler Prozesse werden Gleichungen betrachtet, die dynamische Vorgänge beschreiben. Auch das Ohmsche Gesetz beschreibt einen dynamischen Vorgang. Schreibt man es in der Form
![]() ,
,
so ergibt ![]() die Leistung mit der Dimension
Energie pro Zeit. Unter der Leistung P versteht man die in der Zeiteinheit umgesetzte
Energie, P ist also gleich der in der Zeiteinheit produzierten Ohmschen Wärme,
und es gilt
die Leistung mit der Dimension
Energie pro Zeit. Unter der Leistung P versteht man die in der Zeiteinheit umgesetzte
Energie, P ist also gleich der in der Zeiteinheit produzierten Ohmschen Wärme,
und es gilt
![]() .
.
Die Entropieproduktion ergab sich aus der zeitlichen Ableitung der Entropieänderung, also aus der zeitlichen Ableitung des Quotienten Q/T. Die Ableitung dQ/dt ist schon vorhanden, es muß nur noch durch die Temperatur geteilt werden.
![]() .
.
Die zum Fluß I korrespondierende Kraft ist also der Quotient U/T.
Hier soll von der Gibbsschen Hauptgleichung ausgegangen werden:
![]() .
.
Findet in einem abgeschlossenem System Diffusion statt, so ist dU = 0 und dV = 0, und die Gibbssche Hauptgleichung reduziert sich auf
![]() .
.
Wandert eine Substanz i von einem Ort, an dem ihr chemisches Potential den
Wert ![]() hat, zu einem Ort mit dem chemischen
Potential
hat, zu einem Ort mit dem chemischen
Potential ![]() so ist damit die Entropie-änderung
so ist damit die Entropie-änderung
![]()
verbunden. Die Entropieproduktion erhält man, wenn man die Differentiale zu den Differentialquotienten nach der Zeit ergänzt:
![]() .
.
Damit sind die Flüsse und Kräfte
![]() und
und ![]() .
.
2.3.4. Korrespondierende Flüsse und Kräfte
In der folgenden Zusammenstellung sind die korrespondierenden thermodynamischen Flüsse und Kräfte für einfache irreversible Prozesse gegenübergestellt. Die Dimensionen wurden mit aufgenommen, um deutlich zu machen, daß die Flüsse und Kräfte je nach Vorgang unterschiedliche physikalische Bedeutungen haben, ihr Produkt jedoch immer die Entropieproduktion mit der Dimension Energie pro Zeit und Temperatur ergibt. Ein thermodynamisches System kann man so auffassen, das die thermo-dynamischen Kräfte auf die korrespondierenden thermodynamischen Flüsse wirken.
|
Vorgang |
Flüsse |
Kräfte |
||
|
Einheit |
Einheit |
|||
|
Temperatur- |
|
|
||
|
|
|
|||
|
Expansion |
|
|
||
|
|
|
|||
|
Diffusion |
|
|
||
|
|
|
|||
|
Chemische Reaktion |
|
|
||
|
|
|
|||
|
Elektrischer Strom |
I |
|
||
|
A |
|
Tabelle 1: Korrespondierende thermodynamische Flüsse und Kräfte
Bei der chemischen Reaktion bedeutet ![]() die Affinität,
die Affinität, ![]() steht für
die Reaktionsgeschwindigkeit.
steht für
die Reaktionsgeschwindigkeit.
3. Lineare / nicht-lineare Prozesse
3.1. Zustand nahe des thermodynamischen Gleichgewichtes
Im Thermodynamischen Gleichgewicht verschwinden die thermodynamischen Flüsse und Kräfte, demzufolge wird die Entropieproduktion im Gleichgewicht zu Null. Wird das Gleichgewicht gestört, so wachsen die Flüsse zunächst proportional zu den Kräften. Dies ist der Fall, wenn sich die Zustände der Teilsysteme, zwischen denen Austauschprozesse stattfinden, nicht allzu stark voneinander unterscheiden. Man erhält also eine lineare Verknüpfung, hierbei spricht man von der Thermodynamik linearer irreversibler Prozesse. Solange diese lineare Verknüpfung gilt, befindet sich ein System in einem Zustand nahe dem thermodynamischen Gleichgewicht.
Die lineare Verknüpfung lautet:
![]()
Dies ist eine phänomenologische Gleichung, sie wird auch als Materialgleichung des Systems bezeichnet.
L ist hierbei ein phänomenologischer Koeffizient oder auch Transportkoeffizient des Systems. Er muß stets positiv sein, da die Verknüpfung von J und X eine Vermehrung der Entropie, also eine positive Entropieproduktion, nach sich zieht. Der phänomenologische Koeffizient hängt von bestimmten Systemparametern ab, nicht jedoch von den Flüssen und Kräften selbst. Er läßt sich atomistisch berechnen und steht somit auch für eine physikalische Bedeutung, z.B. für den Diffusions-koeffizienten D, für die thermische Leitfähigkeit l oder für die elektrische Leitfähigkeit s.
Abbildung 2: Entropie S und Entropieproduktion s in der Nähe des thermo- dynamischen Gleichgewichtszustandes
Abbildung 3: Lineare Verknüpfung der thermodynamischen Flüsse und Kräfte in der Nähe des thermodynamischen Gleichgewichtszustandes
3.2. Zustand weitab vom thermodynamischem Gleichgewicht / Bildung dissipativer Strukturen
Gegenstand der physikalischen Untersuchung zur Strukturbildung sind die Gesetze über die Bildung und die Funktion der hochentwickelten Organismen in der gesamten Natur. Von besonderer Bedeutung ist die Frage der Entstehung lebensfähiger Zellen aus der unbelebten Materie, d.h. der Bildung sich selbst reproduzierender, miteinander konkurrierender und sich weiterentwickelnder Organismen.
In den Entwicklungsgesetzen der Physik und der Biologie tritt eine grundlegende Gegensätzlichkeit auf. Der zweite Hauptsatz der Thermodynamik postuliert aufgrund der Erfahrung die Zunahme der Entropie eines abgeschlossenen Systems bis zu einem Extremwert. Der Anstieg der Entropie eines Systems bedeutet, daß sein Ordnungsgrad abnimmt. Nach der Evolutionstheorie von Darwin ist dagegen aufgrund des Selektionsprinzips, d.h. der Auswahl und Durchsetzung im Konkurrenz-kampf der Organismen, die Entwicklung biologischer Systeme durch die Zunahme ihres Ordnungsgrades gekennzeichnet. Mit der Aufklärung dieses Widerspruches hat sich eine Vielzahl von Arbeiten, unter anderen der von Prigogine, beschäftigt.
Die Bildung von Strukturen hohen Ordnungsgrades erfolgt in offenen Systemen, d.h. in Systemen, die mit ihrer Umgebung Stoff und Energie austauschen können.Sie befinden sich bei der Strukturbildung weitab vom thermodynamischen Gleichgewicht mit ihrer Umgebung. Die lineare Verknüpfung zwischen den thermodynamischen Flüssen und Kräften ist im Zustand weitab vom thermodynamischen Gleichgewicht nicht mehr gültig. Statt dessen gelten nicht-lineare Gesetzmäßigkeiten mit den daraus folgenden qualitativen Veränderungen gegenüber den Verhältnissen nahe dem Gleichgewicht. Man spricht hier von der Thermodynamik nicht-linearer irreversibler Prozesse.
Das offene System verändert im Laufe eines Prozesses seine Entropie nach der Bilanzgleichung der Entropie
![]()
Darin bedeutet ![]() die Entropie je Volumeneinheit,
die Entropie je Volumeneinheit,
![]() die Dichte des Entropiestromes und
die Dichte des Entropiestromes und
![]() die aufgrund des zweiten Hauptsatzes
produzierte Entropie, bezogen auf die Raum- und Zeiteinheit. In Übereinstimmung
mit dem zweiten Hauptsatz kann sich die Entropie des offenen Systems verringern
und somit die Bildung von Strukturen höheren Ordnungsgrades erfolgen.
die aufgrund des zweiten Hauptsatzes
produzierte Entropie, bezogen auf die Raum- und Zeiteinheit. In Übereinstimmung
mit dem zweiten Hauptsatz kann sich die Entropie des offenen Systems verringern
und somit die Bildung von Strukturen höheren Ordnungsgrades erfolgen.
Der durch einen gleichmäßigen Strom von Energie, Stoff und Entropie aufrechter-haltene Zustand eines offenen Systems, das mit seiner Umgebung nicht im Gleich-gewicht steht, gegenüber kleinen Störungen und statistischen Schwankungen aber stabil ist, heißt Fließgleichgewicht. Dieser stationäre Gleichgewichtszustand unter-scheidet sich vom Gleichgewichtszustand der bisher betrachteten thermo-dynamischen Systeme, der als statischer Gleichgewichtszustand bezeichnet wird. Wegen der insgesamt erfolgten Entropiezunahme werden die in einem Fließgleichgewicht gebildeten Strukturen nach Prigogine als dissipative Strukturen bezeichnet.
Der Prozeß der Strukturbildung in einem Fließgleichgewicht kann, da er weitab vom statischen thermodynamischen Gleichgewicht erfolgt, nicht durch lineare Ansätze beschrieben werden. Die zu verwendenden mathematischen Gleichungen sind im allgemeinen nicht-linear. Nicht-lineare Gleichungen enthalten in der Regel mehrere stationäre Lösungen. Maßgeblich für die Herausbildung einer dissipativen Struktur ist ihre Stabilität gegenüber kurzzeitigen, in ihrer Intensität begrenzten Störungen. Diese unter dem Einfluß stochastischer Störungen ablaufenden Prozesse treten ohne Rückwirkung auf, d.h. sie sind nur vom gegenwärtigen Zustand abhängig. Solche Prozesse heißen Markow-Prozesse. Führen sie zu Fluktuationen, die sich mit der Zeit verstärken, so ist die Struktur instabil. Klingen die Schwankungen ab, so liegt eine stabile Struktur vor.
4. Formalismus der Thermodynamik irreversibler Prozesse
Im Folgenden soll als Zusammenfassung die Vorgehensweise zur Beschreibung irreversibler Prozesse aufgelistet werden. Diese Methode ist die klassische Thermo-dynamik irreversibler Prozesse. Sie besteht aus folgenden Schritten:
Die klassische Thermodynamik irreversibler Prozesse hat sich als phänomenolo-gische Methode bei der Beschreibung zahlreicher Vorgänge in kontinuierlicher Materie bewährt. Als Beispiel seien Wärme- und Elektrizitätsleitung, Diffusion, innere Reibung und chemische Reaktion sowie deren Kreuzeffekte, wie z.B. Thermo-diffusion, der Diffusions-Thermo-Effekt und Vorgänge der Elektrochemie genannt. Ferner können zahlreiche Vorgänge in anisotropen Medien, in Systemen, die sich in elektromagnetischen Feldern befinden, Vorgänge an Oberflächen bzw. Phasen-grenzen sowie Vorgänge mit inneren Umwandlungen, wie sie etwa in hochpolymeren Kunststoffschmelzen auftreten, in methodisch einheitlicher Weise beschrieben werden.
Bei allen Erfolgen der Theorie sollte aber nicht übersehen werden, daß es noch eine Reihe von Erscheinungen gibt, welche sie nicht beschreiben kann. Beispiele dafür sind Hystereseerscheinungen wie z.B. der Ferromagnetismus oder die Ferroelektrizität, ferner die Plastizität sowie Vorgänge in Stoßfronten und Mehrphasensystemen.
5. Literaturverzeichnis13. August 2000, Udo Becker